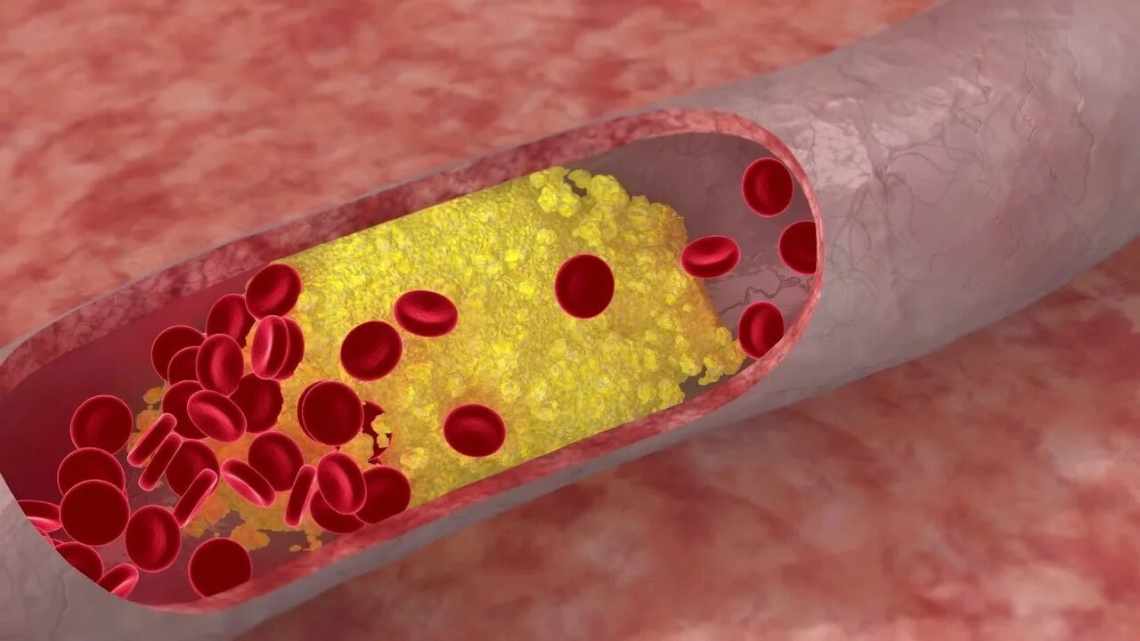
Атеросклеротична бляшка в розрізі.
Атеросклероз - це захворювання, що порушує нормальний кровотік в артеріях і, в кінцевому рахунку, стає причиною інфарктів та інсультів. Атеросклероз характеризується появою на внутрішній поверхні судин атеросклеротичних бляшок, що представляють собою скупчення «поганого» холестерину. Бляшки пошкоджують артерії, що призводить до появи тромбів, кров'яних згустків, здатних закупорити посудину і порушити кровопостачання життєво-важливих органів.
Швидкість прогресування атеросклерозу залежить як від генетичних особливостей пацієнта, так і від його дієти. При цьому важливу роль у розвитку атеросклерозу відіграє запальний процес, що виникає в місці прикріплення бляшки до стінки судини.
"Навіть найсучасніші та найефективніші препарати для зниження холестерину, інгібітори PCSK9, не кажучи вже про широко використовувані статини, не здатні нівелювати той збиток, який атеросклероз з часом завдає судинам. Ці ліки не можуть запобігти 500 тис. інфарктів, що відбуваються в США щорічно, - говорить керівник дослідження доктор Едвард Фішер (Edward Fisher), директор Програми Марка і Руті Белл в області судинної біології та захворювань (Marc and Ruti Bell Vascular Biology and Disease Program) - Нам потрібні препарати наступного покоління, засоби, які були б націлені на імунну реакцію, що викликається в організмі накопиченим холестерином, і ліки, здатні "розчинити" холестеринові бляшки ".
Осідаючи в артеріях, «поганий» холестерин (точніше, ліпопротеїни низької щільності) провокує імунну відповідь, тобто, бляшки стають причиною запалення. Моноцити, клітини імунної системи, прямують до місць скупчення холестерину і перетворюються на макрофаги двох різновидів, або «запальних», або «цілющих».
Під час низки попередніх досліджень вченим вдалося показати, що «спеціалізація» моноцитів пов'язана з прогресом (або ж регресом) атеросклерозу. Якщо моноцити перетворюються на макрофаги типу M1 («запальні»), хвороба прогресує. Ці клітини стимулюють запалення. І навпаки, зменшення загальної кількості макрофагів у бляшках і збільшення частки «цілющих» макрофагів M2 пов'язують з регресом захворювання і зменшенням розмірів бляшок. Збільшення чисельності макрофагів M2 призводить до зменшення вираженості мікротравм, що з'являються на стінках судин через бляшок. А це, в свою чергу, знижує ризик атеросклеротичних ускладнень: тромбозів, інфарктів та інсультів.
Під час нового дослідження вчені з'ясували, що «лікувальні» макрофаги типу M2 необхідні для зменшення атеросклеротичного запалення і «розчинення» бляшок. Принаймні, це вдалося продемонструвати на піддослідних мишах. Для роботи вчені вивели спеціальну лінію мишей, моноцити яких не були здатні до міграції в бляшки. Цих мишей годували жирною їжею, що імітує стандартну «західну дієту», що призвело до підвищення рівня холестерину і розвитку атеросклерозу. Потім дослідники пересадили вражену атеросклерозом мишачу аорту звичайним здоровим мишам. Таким чином, кровоносна посудина з бляшками виявилася наповнена кров'ю з нормальним вмістом холестерину. Це негайно призвело до збільшення кількості макрофагів M2 в бляшках і регресу останніх. Якщо ж аорта підсаджувалася мишам з виведеної для експерименту лінії, то поліпшення стану судини не спостерігалося. Подібні результати були отримані і в експериментах без застосування хірургічних методів.
Якщо говорити про клінічне застосування результатів нової роботи, то поки не цілком ясно, як змусити моноцити перетворюватися саме на «корисні» макрофаги. Незрозуміло, зокрема, чи може зниження рівня холестерину у пацієнта само по собі стимулювати появу макрофагів типу M2. Але нові техніки візуалізації незабаром можуть надати вченим шанс вивчити кількісний і якісний склад популяції макрофагів у бляшках. Незабаром, якщо дослідники зрозуміють, як спровокувати вироблення більшого числа макрофагів M2, можуть з'явитися нові терапевтичні підходи до лікування атеросклерозу. На думку доктора Фішера, важливо, щоб ці підходи працювали на стадії, коли хвороба ще не призвела до появи тромбів - по досягненню цієї точки порушення приймають незворотний характер.
Зараз автори нового дослідження намагаються виявити місцеві сигнальні шляхи, що «говорять» моноцитам, що їм необхідно перетворитися на макрофаги типу M2. Серед можливих кандидатів на роль провідника цієї інформації - інтерлейкін-4 та інтерлейкін-13. У попередніх дослідженнях було показано, що ці з'єднання пов'язані з дозріванням M2-макрофагів. Вони запускають сигнальний шлях STAT6, що відправляє білок в ядро. У ядрі білок запускає гени, що змушують моноцит перетворитися на макрофаг типу M2. Нове дослідження підтвердило, що блокування цього сигнального шляху призводить до зниження чисельності M2-макрофагів у бляшках, що зменшуються.
Зараз група дослідників під керівництвом доктора Фішера експериментує з наночастинками, створеними на основі «хорошого» холестерину, відомого своєю здатністю транспортувати «поганий» холестерин з бляшок у печінку для подальшого розкладання. Один з варіантів наночастинок буде також доставляти в бляшки інтерлейкін-4. Наступним кроком стане випробування наночастинок на свинях, а потім, якщо все пройде успішно, настане черга досліджень за участю людей.